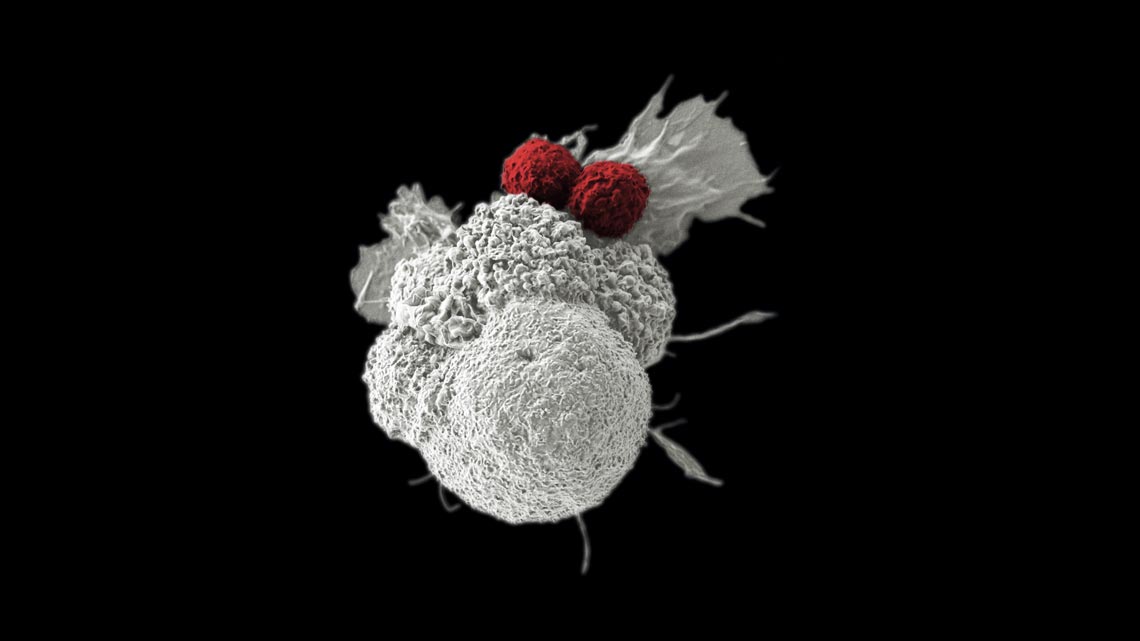
Microscopia eletrônica mostra célula tumoral (em branco) sob o ataque de dois linfócitos T, artificialmente coloridos (em vermelho)
Rita Elena Serda / Instituto Nacional do Câncer (NCI) / Duncan Comprehensive Cancer Center at Baylor College of Medicine
Vamberto Luiz de Castro não esperava viver mais muito tempo quando chegou ao Hospital de Clínicas da Universidade de São Paulo em Ribeirão Preto (USP-RP) em agosto deste ano. Tinha um câncer avançado e havia perdido quase 20 quilos nos meses anteriores. Em 2017, esse funcionário público aposentado de Belo Horizonte havia sido diagnosticado com um linfoma decorrente da proliferação dos linfócitos B. Em pessoas saudáveis, essas células produzem anticorpos contra vírus, bactérias e outros elementos estranhos ao organismo. Em pessoas com câncer, porém, passam a se multiplicar descontroladamente. Os médicos que inicialmente atenderam Castro tentaram combater a doença com medicamentos e radiação. Com a ineficácia dos tratamentos, deram-lhe mais um ano de vida. O aposentado mineiro estava sob cuidados paliativos, recebendo morfina para suportar a dor, quando seu filho Pedro Augusto soube de um tratamento inovador e arriscado que começaria a ser oferecido de modo experimental no país.
Em Ribeirão Preto, pesquisadores liderados pelo hematologista Dimas Tadeu Covas haviam concluído pouco tempo antes o desenvolvimento de uma terapia inédita na América Latina e se preparavam para oferecê-la como tratamento compassivo (quando se esgotaram as alternativas terapêuticas) para pessoas com dois tipos de câncer – um deles, o de Castro. Seu nome é complicado: terapia com linfócitos T com receptores quiméricos de antígeno, ou, em uma versão enxuta em inglês, CAR-T cell therapy.
Nesse tratamento, a equipe médica extrai um tipo de célula de defesa – os linfócitos T – do sangue do paciente (para evitar rejeição) e o modifica geneticamente em laboratório para que identifique e destrua as células do tumor. Em indivíduos saudáveis, os linfócitos T naturalmente reconhecem e eliminam células doentes, como as tumorais. Estas, no entanto, às vezes escapam dessas sentinelas do corpo. Nos últimos 30 anos, descobriu-se como dar uma mãozinha para os linfócitos T executarem a tarefa. Bastava inserir no genoma deles a receita de uma proteína que fica exposta em sua superfície externa e tem afinidade com as células a serem destruídas – a estratégia funciona bem contra os linfócitos B.
Dominado recentemente pelo grupo da USP, o tratamento é uma forma promissora de combater tumores causados por proliferação dos linfócitos B e resistentes a químio e radioterapia. Quem primeiro mostrou sua viabilidade foi o imunologista israelense Zelig Eshhar, em 1989. De lá para cá, grupos nos Estados Unidos aperfeiçoaram a manipulação das células e a segurança da terapia, testada pela primeira vez em seres humanos há cerca de 10 anos. O desenvolvimento de variações do tratamento decolou em 2013 e hoje existem cerca de 680 versões em diferentes estágios de desenvolvimento.

Infográfico e ilustração Alexandre Affonso
Apesar dessa explosão de possibilidades, só duas terapias com células CAR-T são comercializadas para uso clínico. Uma para tratar um tipo de leucemia (câncer do sangue) e outra para combater linfomas, ambos decorrentes da proliferação de linfócitos B.
O primeiro foi desenvolvido na Universidade da Pensilvânia, Estados Unidos. Essa terapia foi aprovada pela agência regulatória de medicamentos norte-americana (FDA) para leucemia linfoblástica aguda de células B resistente aos medicamentos convencionais. Lá, o tratamento, chamado Kymriah, sai por US$ 475 mil, fora o custo hospitalar. Uma revisão publicada em 2018 no New England Journal of Medicine indica que de 70% a 90% das pessoas tratadas apresentam regressão do câncer logo após a terapia. Com o tempo, 25% voltam a ter leucemia.
No Instituto Nacional do Câncer (NCI) dos Estados Unidos, criaram o segundo tratamento, comercializado com o nome de Yescarta, contra linfomas de linfócitos B que não cedem às terapias tradicionais, como o do aposentado mineiro. Seu custo é de US$ 370 mil, ainda assim proibitivo para muitos que poderiam se beneficiar dele. Entre 65% e 85% das pessoas com linfoma de linfócitos B grandes inicialmente apresentam redução do tumor, mas só para metade delas a resposta é completa e duradoura.
Como nenhuma das terapias está aprovada no Brasil, uma alternativa para Castro seria buscá-la no exterior. O problema era o custo. O procedimento sairia por quase US$ 1 milhão, afirmou o aposentado ao podcast do jornal O Globo, em outubro, dias após receber alta do Centro de Terapia Celular (CTC) da USP em Ribeirão Preto, onde foi tratado com as células CAR-T.
“Em 2018 nosso grupo já havia dominado o ciclo de produção dessas células e estava maduro para atender os primeiros pacientes”, conta Covas, coordenador do CTC, um dos Centros de Pesquisa, Inovação e Difusão (Cepid) apoiados pela FAPESP, e atual diretor do Instituto Butantan. “São poucos os lugares no mundo com capacidade de proporcionar esse tratamento.” Por prudência, a equipe adiou a oferta da terapia em modo compassivo até que o hematologista Renato Cunha retornasse do NCI, onde passou uma temporada aprendendo a manejar os efeitos colaterais, que são intensos e podem matar.
Injetadas no sangue, as células CAR-T iniciam uma perseguição. Quando encontram um linfócito B, aderem a ele e lançam um banho de compostos químicos (citocinas) que o matam – seja ele saudável ou tumoral. Necessário para eliminar as células tumorais, esse banho químico, a tempestade de citocinas, é um sinal de que o tratamento está funcionando. Em níveis elevados, no entanto, esses compostos baixam a pressão sanguínea e causam extravasamento de líquidos para os órgãos.
“Um efeito adverso preocupante é o edema cerebral”, relata o imunologista norte-americano Kenneth Gollob, chefe do Grupo de Imuno-oncologia Translacional do ACCamargo Cancer Center, em São Paulo, que busca novos alvos para as células CAR-T. “Para lidar com esses efeitos, é preciso ter uma equipe clínica bem preparada, além de acesso rápido a uma unidade de terapia intensiva e a medicamentos para controlar os efeitos colaterais da tempestade de citocinas”, afirma Covas.
Quando Castro foi à primeira consulta em Ribeirão, o grupo do CTC já tinha linfócitos T de outros pacientes em preparo para o primeiro tratamento. A gravidade de seu caso, porém, levou os médicos a alterarem a ordem dos procedimentos. O linfoma havia progredido rapidamente e tomado o interior dos ossos. O paciente sentia dores excruciantes e febre intermitente, além de suores que, à noite, encharcavam sua roupa e a cama. “Nesse estágio, as células tumorais se reproduzem tão rapidamente e têm um metabolismo tão elevado que é como se o paciente praticasse atividade física durante o sono”, relata Covas.
A decisão de oferecer o tratamento havia sido precedida de longo preparo. Estruturado há duas décadas, o CTC tem ampla experiência em transplantes de medula óssea e havia sido pioneiro no país no uso de células-tronco para tratar doenças autoimunes, como o diabetes tipo 1. O aprimoramento na produção de células CAR-T, os resultados promissores nos testes in vitro e com animais e os primeiros usos bem-sucedidos em humanos levaram o grupo de Ribeirão a investir no domínio das etapas necessárias para, de modo independente, criar uma linha de produção de células CAR-T.
Uma forma de produzir essas células exige o uso de vírus. São eles que inserem no genoma dos linfócitos T os genes com a receita das proteínas que os direcionam contra os linfócitos B. Em geral, cada grupo de pesquisa ou empresa farmacêutica desenvolve uma estratégia de produção e patenteia suas etapas ou as mantém em segredo. Por essa razão, a equipe da USP optou por criar a sua própria. “Inicialmente, pensamos em comprar os vírus de laboratórios norte-americanos”, conta a bióloga Virginia Picanço e Castro, do CTC, coautora do livro Chimeric antigen receptor T Cells, a ser publicado em 2020 (editora Humana Press). “Como a importação é complexa e cara, decidimos desenvolver aqui essa etapa.”
Foram necessários quatro anos de trabalho, inclusive com o treinamento no exterior, para dominar as etapas de produção do vetor viral e de multiplicação dos linfócitos T geneticamente modificados. Picanço e Castro passou um período na Universidade Purdue, nos Estados Unidos, aprendendo a preparar o vírus, enquanto a química Amanda Mizukami foi para a Universidade de Washington treinar o cultivo dos linfócitos geneticamente modificados. As duas etapas são essenciais ao desenvolvimento da terapia e, no retorno ao Brasil, as pesquisadoras as implantaram em Ribeirão.
Na USP, Picanço e Castro e sua equipe aprenderam a gerar uma versão inofensiva do vírus da imunodeficiência humana (HIV) para inserir os genes nos linfócitos T. O engenheiro biotecnológico Pablo Moço produziu uma variante do vírus livre dos genes que o tornam nocivo e Mariane Tirapelle, também engenheira biotecnológica, trabalha para aprimorar a produção e torná-la mais barata. Após incorporar ao material genético do vírus os genes a serem inseridos nos linfócitos T, coube a Mizukami multiplicar em laboratório as células geneticamente modificadas. Nos testes in vitro, as células CAR-T do CTC eliminaram 90% dos linfócitos B em um dia. Segundo os resultados publicados em outubro na revista Hematology, Transfusion and Cell Therapy, elas também controlaram o linfoma de células B em camundongos.
“Esse passo tecnológico fundamental foi possível porque já tínhamos expertise em montagem e manipulação de vetores virais e no cultivo de células em biorreatores, tudo seguindo as boas práticas de fabricação exigidas para terapia em seres humanos, desenvolvidas para a realização de transplantes de medula óssea”, relata Covas. “Dominamos todo o ciclo e só conseguimos fazer isso no setor público de saúde por causa do investimento em pesquisa feito por agências financiadoras como a FAPESP e o Conselho Nacional de Desenvolvimento Científico e Tecnológico [CNPq].” Ao todo, 20 pessoas do Cepid atuaram para desenvolver o tratamento: cinco médicos, cinco pesquisadores, sete alunos de pós-graduação e estagiários em pós-doutoramento, além de três técnicos de laboratório.
No início de agosto, a equipe médica do CTC coletou linfócitos T de Vamberto Castro e os enviou ao laboratório para serem geneticamente manipulados. Cerca de 40 dias mais tarde, em 9 de setembro, o aposentado foi internado para receber suas células de volta, agora transformadas em CAR-T. Dois dias após a infusão, o efeito começou a se tornar evidente: foi possível reduzir a morfina e veio a tempestade de citocinas. Castro entrou em choque circulatório. A pressão sanguínea baixou e foi preciso hidratá-lo, além de administrar anticorpos para conter as citocinas. Quatro dias mais tarde, ele estava melhor e passou para a enfermaria. “Um mês depois da infusão não havia mais evidência de linfócitos B neoplásicos no sangue e os exames de imagem mostravam uma redução drástica do linfoma”, afirma Covas.
Em 11 de outubro, Castro teve alta e foi para casa. Considerado em remissão clínica e com evolução favorável, será acompanhado pelos médicos de Ribeirão pelos próximos anos. A proteção das células CAR-T deve durar enquanto elas permanecerem vivas no organismo. Parte das pessoas que passam pelo tratamento, porém, pode voltar a ter o mesmo tumor – seja porque as células CAR-T se tornam inativas, seja porque as células neoplásicas sofreram alterações que lhes permitem driblar os linfócitos geneticamente modificados.
“Esse resultado é um indício importante de que a terapia funciona”, afirma o biomédico Martín Bonamino, do Instituto Nacional do Câncer (Inca), no Rio de Janeiro. “Como o tratamento é recente, ainda é cedo para saber se haverá recidiva”, pondera o pesquisador, que há 15 anos trabalha no desenvolvimento de células CAR-T.
Sistema robotizado
“O caso tratado em Ribeirão mostra que a ciência brasileira tem capacidade de desenvolver terapias altamente sofisticadas”, comenta Kenneth Gollob, que, com o hematologista Jayr Schmidt Filho, trabalha para implantar um centro de imunoterapia celular no ACCamargo.
Para o hematologista Nelson Hamerschlak, da Faculdade de Ciências da Saúde ligada ao Hospital Israelita Albert Einstein, em São Paulo, é o coroamento do esforço de um grupo com grande experiência em terapia celular. No Einstein, as equipes de Hamerschlak e da biomédica Luciana Marti criaram recentemente vetores e construíram sequências de DNA codificando fragmentos de uma proteína de um vírus (citomegalovírus) para serem inseridos em linfócitos T. O procedimento deve levar os linfócitos T a atacarem tanto os linfócitos B quanto o citomegalovírus, que pode danificar órgãos de pessoas submetidas a transplante de medula óssea. Em vez de montar uma estrutura complexa como a da USP, o grupo do Einstein optou por adquirir um equipamento que produz essas células de modo automatizado e está teste em centros norte-americanos.
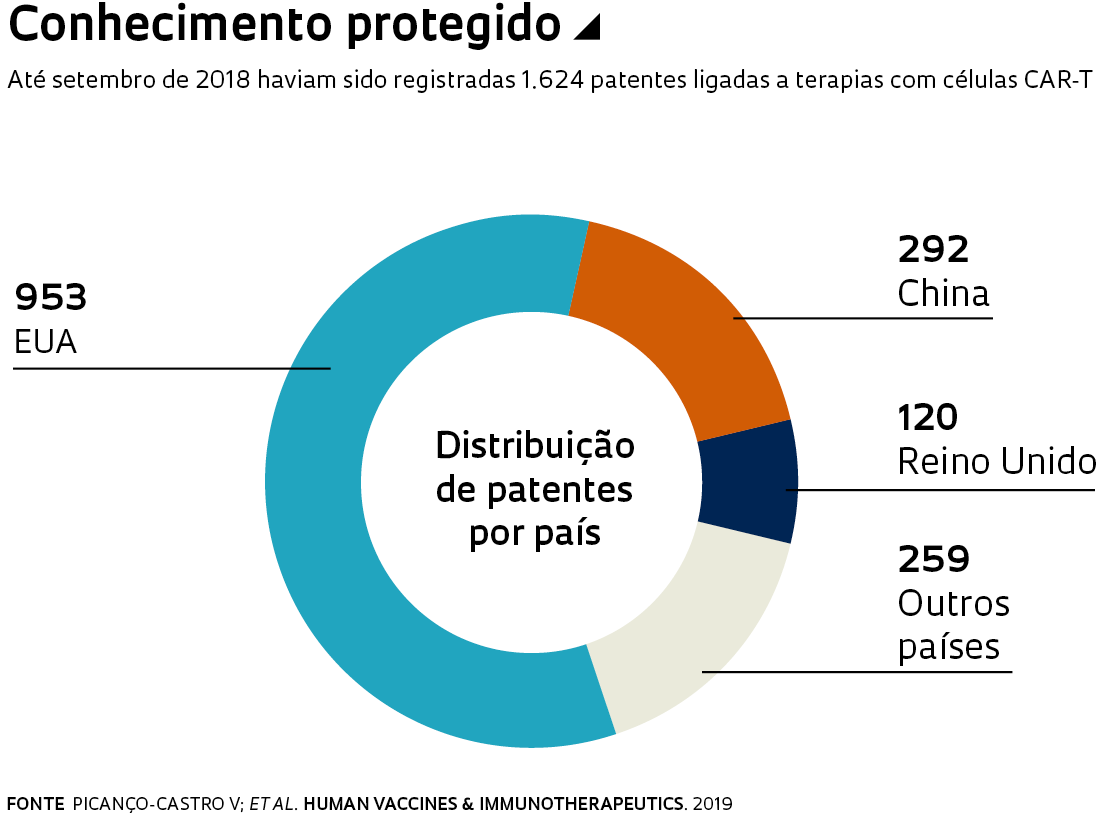
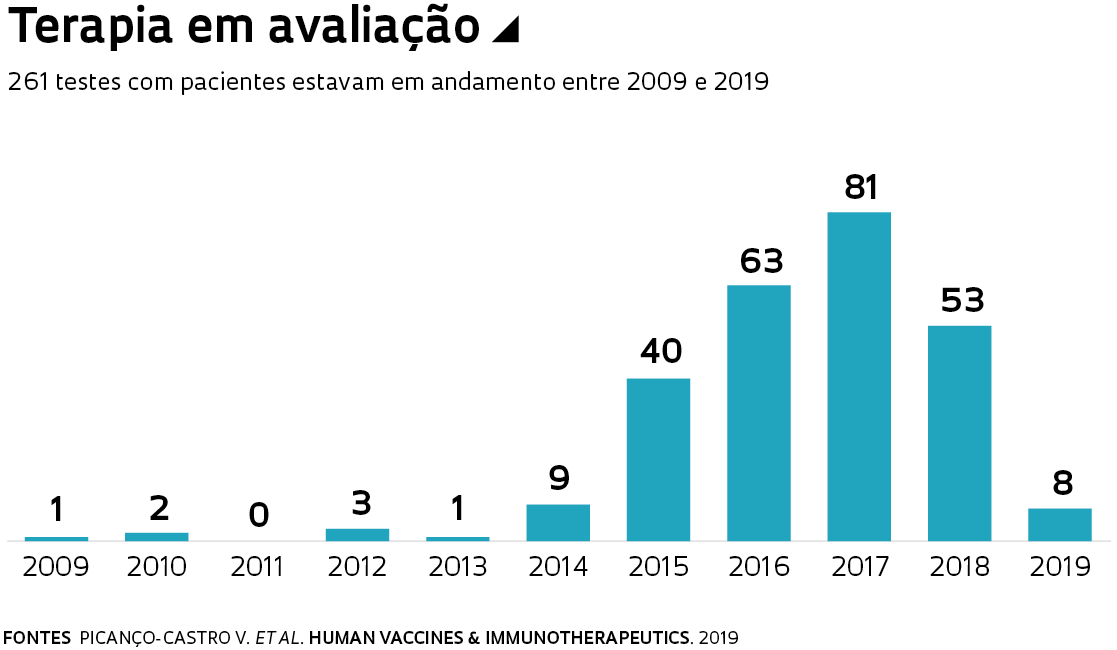
Resultados promissores do tratamento levaram a uma diversificação de técnicas de produção e de alvos das CAR-T. Em setembro de 2018, havia 679 terapias distintas, envolvendo 1.624 patentes, segundo levantamento feito pelos grupos de Picanço e Castro e da pesquisadora na área de gestão de inovação e empreendedorismo Geciane Porto, da Faculdade de Economia, Administração e Contabilidade da USP-RP. Publicado em novembro na Human Vaccines & Immunotherapeutics, o trabalho indica que parte importante desses tratamentos (218) tinha como alvo os linfócitos B, associados aos tumores hematológicos. Outros 95, no entanto, haviam sido desenvolvidos – e estavam em estágios iniciais de teste – contra tumores sólidos, que atingem o cérebro, a mama e outros órgãos.
Além de tentar ampliar as possibilidades da terapia, diferentes grupos buscam técnicas mais simples e seguras de alterar os linfócitos T. No Inca, a equipe de Bonamino trabalha em uma estratégia de produção de células CAR-T que dispensa o uso de vírus. A técnica se vale de fragmentos de DNA chamados transposons para inserir os genes desejados nos linfócitos T. Os transposons mudam de posição no genoma. Tempos atrás, porém, foi desenvolvida uma variedade apelidada de “bela adormecida”, que pode ser aplicada terapeuticamente.
Com essa estratégia, o grupo do Inca produziu células CAR-T, que, ao mesmo tempo, combatem linfócitos B neoplásicos e o vírus Epstein-Barr, que pode causar leucemia em pessoas com o sistema imunológico debilitado. Essas células CAR-T se mostraram eficientes em testes com células in vitro e em camundongos com leucemia, segundo estudo publicado em abril na Human Gene Therapy. Em um trabalho mais recente, Bonamino e sua equipe mostraram que talvez seja possível saltar a etapa de multiplicação in vitro das células CAR-T, o que consome dias de preparo e pode exauri-las. “Estamos caracterizando cada etapa desses protocolos antes de testá-los em pacientes”, afirma o pesquisador do Inca.
Caso os estudos em andamento confirmem a eficácia das células CAR-T contra leucemias e linfomas, essa terapia pode se tornar uma alternativa ao uso de anticorpos, que precisam ser administrados por toda a vida, e ao transplante de medula óssea, mais agressivo. Cálculos iniciais feitos por Bonamino indicam que cerca de 900 brasileiros com um desses tipos de câncer poderiam ser candidatos ao tratamento com as células geneticamente modificadas a cada ano.
Um desafio será torná-lo acessível a mais pessoas. “No momento, cada país busca uma saída”, diz Covas. Ele estima que a terapia aplicada em Ribeirão Preto tenha saído por menos de R$ 100 mil. Esse valor inclui os gastos hospitalares e com insumos, além do tempo de trabalho da equipe, e é inferior ao do tratamento comercial por aproveitar a infraestrutura disponível na universidade.
Na Inglaterra, por exemplo, o governo negociou com as empresas farmacêuticas a compra dos tratamentos por valor inferior ao de mercado para oferecer no sistema público de saúde. Para Gollob, do ACCamargo, os preços devem cair se os resultados continuarem positivos e a população exigir acesso ao tratamento. “A criação de plataformas nacionais que permitam produzir células CAR-T em grande escala também pode ajudar a diminuir o custo”, argumenta.
Hoje a equipe de Ribeirão Preto estima ter capacidade de tratar dois pacientes a cada 40 dias (ela não informa se já iniciou outro tratamento) porque a capacidade de produção das células ainda é pequena. “Nosso grupo dominou todo o ciclo de produção dessas células. Precisamos ampliar a capacidade de produção, com um investimento relativamente modesto”, explica Covas. Estima-se que seriam necessários cerca de R$ 10 milhões. Por ora, é difícil calcular a potencial economia que o tratamento poderia gerar para o setor público de saúde. “O paciente que tratamos estava com câncer havia dois anos e tinha passado por quatro terapias diferentes no SUS”, lembra Covas.
Projetos
1. Centro de Terapia Celular (CTC) (n° 13/08135-2); Modalidade Centro de Pesquisa, Inovação e Difusão; Pesquisador responsável Dimas Tadeu Covas (USP); Investimento R$ 45.925.435,79.
2. INCT 2014: Em células-tronco e terapia celular no câncer (nº 14/50947-7); Modalidade Projeto Temático; Pesquisador responsável Dimas Tadeu Covas (USP); Investimento R$ 3.324.699,34 (CNPq/FAPESP).
Artigos científicos
PICANÇO-CASTRO, V. et al. Establishment of a simple and efficient platform for car-t cell generation and expansion: from lentiviral production to in vivo studies. Hematology, Transfusion and Cell Therapy. 9 out. 2019.
PICANÇO-CASTRO V.; PEREIRA, C. G.; et al. Emerging CAR T cells therapies: clinical landscape and patent technological routes. Human Vaccines & Immunotherapeutics. 8 nov. 2019.
CHICAYBAM, L. et al. CAR T cells generated using Sleeping Beauty transposon vectors and expanded with an EBV-transformed lymphoblastoid cell line (LCL) display antitumor activity in vitro and in vivo. Human Gene Therapy. v. 30, n. 4, p. 511-22. Abr. 2019.
Fonte:






















